De la teoría a la práctica
por Julián Segarra Esbrí.
Es la divertida historia de lo que aconteció a un compañero de D. Pedro Monzó Fuster, cuando puso en práctica los conocimientos adquiridos de sus Maestros durante los años de estudios.
A medida que vamos cumpliendo años nos vamos creyendo mayores, con capacidad de decidir y es entonces cuando se nos vé el plumero de nuestra propia inocencia e ignorancia. En muchas ocasiones nos aburrimos en clase y pensamos que las enseñanzas que recibimos de nuestros Maestros no nos van a servir en nuestra vida; cuanto menos sabemos, más sabios nos creemos y viceversa, cuanto más sabemos, más conscientes somos de lo poco que sabemos.
A continuación me voy a dirigir a ustedes, alumnos de Física y Química del Instituto de Ayora (Valencia), por mediación y cortesía de mi compañero de estudios y maestro suyo D. Pedro Monzó Fuster, con quien compartí, por qué no decirlo, muchos sustos examinísticos; recuerden siempre que, antes de udes., ahí sentados, estuvimos nosotros y después, vendrán otros a padecer, los mismos no, pero si, parecidos sufrimientos.
Durante veinte años fui a la escuela cada día soportando las lecciones de las asignaturas, en ocasiones con agrado e ilusión y en otras, aburriéndome totalmente, incluso llegando a dormirme, pero les puedo asegurar que nunca pensé que tal o cual asignatura no sirviese para nada, nunca he visto un libro que no tenga una página o una línea útil, lo mismo ocurre con las asignaturas, siempre hay una lección interesante o por lo menos, su moraleja.
Cuando me aprobaron las asignaturas del último curso de los estudios universitarios, porque estudiar, aún lo estoy haciendo ahora, es más, recuerdo a mi abuelo que, a los noventa años aún estudiaba, me incorporé al Servicio Militar. Allí en el Cuartel, estuve un año de vacaciones, tiempo que intenté aprovechar. Pensé que cuando acabaría mi deber patrio, tendría dos opciones, a saber, esperar a que alguien solicitase mis servicios y le sacase las castañas del fuego a cambio de unas pesetas, o dedicarme por mi cuenta a desarrollar alguna iniciativa de las inmensas posibilidades que ofrecía mi espíritu y acreditar mi sapiencia.
Corno por entonces solo ganaba quinientas pesetas al mes, pensé que tenía que buscarme un oficio donde la materia prima fuese barata y así la inversión siempre sería pequeña, por lo que me ví obligado a desechar oficios como perfumería, joyería, petróleos, etc., etc., etc.
Gracias a las enseñanzas recibidas de mis Maestros, caí en la cuenta de que en este planeta Tierra, lo que más abunda es el agua, de hecho, los mares cubren las 3/4 partes de la superficie de La Tierra y en ella, se encuentra algo muy apreciado por el hombre, no siendo precisamente los langostinos o los atunes, sino que por estar disuelto no se ve; fíjense udes. de su importancia, que los antiguos se desvivían por conseguirlo y lo recibían como recompensa a su trabajo, de hecho, se llama salario a la paga o sueldo.
Por ello, con los ahorros de las quinientas pesetas mensuales de la Mili, decidí, al ser el agua marina tan barata, el montar el negocio de una salina. ¡Al precio de esta materia prima, cualquiera puede ser hombre de ideas cristalinas!.
Es aquí donde empiezan las primeras dificultades. ¿Dónde instalarla? El primer capítulo a resolver es la optimización.
De los 3.286 Km. de costa que tiene España sólo en la Península Ibérica, elegir el emplazamiento, no es tarea fácil. Aprovechando el permiso de un soldado de Los Caños de Meca. Para los que piensen que la geografía no sirve para nada, les diré que gracias a los Maestros que me la enseñaron, ahora les puedo decir a udes. que Los Caños de Meca es un pueblecito de la provincia de Cádiz, situado justito al lado del Cabo de Trafalgar y sus aguas las baña el Océano Atlántico; pero continuando con el tema, le pedí a este soldado que a su regreso me trajese una botella de agua del mar de su pueblo y así lo hizo, la cual yo rotulé como:
Los Caños de Meca (Cádiz) M - l.
Hábilmente fui utilizando los permisos de otros soldados compañeros de Mili y así recogí una colección de botellas de agua de los mares de la geografía española, los cuales iba rotulando como:
Vigo (Pontevedra) M - 2.
San Ciprián (Lugo) M - 3.
Cuevas del Mar (Asturias) M - 4.
Lequeitio (Vizcaya) M - 5.
San Martín de Ampurias (Gerona) M - 6.
Torredembarra (Tarragona) M - 7.
Peñíscola (Castel1ón) M - 8.
El Perelló (Valencia) M - 9.
Torrevieja (Alicante) M - l0.
Balerna (Almería) M - 11.
Estepona (Málaga) M - 12.
Recuerdo que un soldado de Covaleda, los expertos en geografía habrán adivinado que se trata de un pueblo al sur de los Picos de Urbión, en la provincia de Soria, sabedor de que mis compañeros me traían agua de sus pueblos, se ofreció a traerme una botella; algunos de ustedes pensarán para qué querría yo agua de Covaleda, si en Covaleda no hay mar, pues cierto, no lo hay, pero por Covaleda pasa el Río Duero, sus aguas son puras y cristalinas, dado que muy cerquita de allí nace este importante río español y su muestra me sirvió de referencia cero. No olviden udes. que: ¡Hay cantidad de..., cuando hay relación con...!.
Terminé la Mili con una verdadera colección de botellas de agua marina, ahora el problema reside en averiguar la cantidad de sal que contiene cada una. Los avispados de entre ustedes, que seguro los hay, habrán pensado que esto no es problema, se compra un evaporizador y una balanza, con el primero se separa la sal del agua y con el segundo se pesa y el problema está resuelto. ¡Ji!, ¡ji!, ¡ji!, ¿no han caído en la cuenta que con quinientas pesetas mensuales de paga no se puede comprar un evaporizador y una balanza?, lo siento, este procedimiento no me sirve, hay que pensar en otra cosa.
Si el procedimiento físico de la evaporación y pesada como método de análisis es caro por el instrumental, tal vez fuese adecuado uno químico; recordando que el ClAg es una sal blanca insoluble en el agua, podría hacerla reaccionar con el ClNa, ejemplo:
ClNa + H2O → Cl - + Na+
NO3Ag + H2O → NO3- + Ag+
__________________________________________
Cl - + Ag+ → ClAg (precipitado blanco).
se filtra y se pesa y nos ahorramos el evaporizador.
Como comprenderán, no me puedo permitir el lujo de utilizar la plata para conocer la cantidad de sal del agua del mar. Está fuera de mis posibilidades económicas, luego este método tampoco me sirve, hay que pensar en algo y que sea ¡barato!.
Fue entonces cuando recordé que en una colección de cromos del chocolate de cuando era pequeño, un barco con el mismo lastre se hunde más al navegar por un río que en el mar. Así que me pregunté ¿por qué flotan las cosas?.
Recordando los Postulados de la Dinámica, llegué al Principio de Acción y Reacción:
Si un punto de un cuerpo, ejerce una fuerza de acción sobre un punto de otro, éste reacciona siempre de forma que el punto segundo ejerce sobre el primero otra fuerza de reacción igual y contraria.
Así fui a parar al Principio de Arquímedes:
Todo cuerpo sólido sumergido en un líquido, a parte de salir mojado, experimenta un empuje E, fuerza resultante vertical dirigida de abajo arriba igual y opuesta al peso del líquido que desocupa.
Si el cuerpo sólido está totalmente sumergido en el líquido de densidad d, según el Principio de Arquímedes, el empuje E, valdrá:
E = V · d · g
donde E = empuje, V = volumen, d = densidad y g = gravedad.
Por consiguiente, el empuje dependerá de la densidad del medio, puesto que el volumen y la gravedad son constantes. Luego si un barco recibe diferente empuje en un río que en un mar, será porque la densidad del agua es diferente y a la vez, lo será por su concentración salina.
Tengo que reconocer que me entusiasmé con este método de análisis por lo original. Podía haber utilizado cualquier procedimiento para medir densidades como la balanza hidrostática, el picnómetro, el aerómetro, o incluso la balanza de Mohr-Westphal, pero en cualquier caso tenía que comprarme el invento y su precio lo hacía prohibitivo, por consiguiente, cogí a la idea de la oreja y la llevé a la práctica, para ello, fui a ver al Sr. Joaquín el herrero y le pedí un trozo de hierro; me dio un cacho de varilla cilíndrica, que después de adecentarla un poco, resultó un bonito cilindro. Con el pie de rey medí que tenía 14'0 mm. de diámetro y 62'5 mm. de largo.
Recordaba de las lecciones de geometría como se averigua el volumen del cilindro y no tuve dificultades para calcularlo:
V = 2 · π · r · l
en donde V es de volumen, r es el radio y l es la longitud. Luego aplicando la fórmula: V= 9'62 cm3.
Gracias a que mi amigo Salvador tenía en su tienda una balanza con la que su padre antaño pesaba las especias, (cilantro, cominos, claveles, pimienta, canela, etc.) aproveché para que me pesase el trozo de hierro, resultando un valor de 75'25 g., es decir: M = 75'25 g.
Como el peso del cuerpo es: P = Mc · g = Vc · dc · g,
donde: Mc es la masa del cuerpo, Vc es el volumen del cuerpo, dc es la densidad del cuerpo, g es la gravedad.
por el Principio de Arquímedes, al sumergirlo su empuje E será V · d · g.
El peso aparente del cuerpo sumergido, será igual: Pa = P - E = Vc ·dc· g - V · d · g.
y como el volumen del cuerpo es el mismo que el volumen desalojado, Vc = V,
Pa = V · g · (dc - d)
siendo Pa el peso aparente, Vc es el volumen del cuerpo, V es el volumen del medio desalojado, g es la gravedad, dc es la densidad del cuerpo, d es la densidad del medio desalojado.
Luego si la densidad del cuerpo dc es mayor que d, la densidad del medio, el peso del cuerpo es superior al empuje y el cuerpo se hunde.
Si dc es menor que d, el peso del cuerpo es inferior al empuje y el cuerpo flota.
Si dc = d, el peso del cuerpo es igual al empuje, el cuerpo está en equilibrio.
Ahora ya puedo contestar a la pregunta del por qué las cosas flotan, ¡está claro!, las cosas flotan por la densidad.
Por tanto, voy a calcular la densidad; sabiendo que P = M · g = V · d · g,
luego si M = V · d, despejando obtengo d = M : V .
Para el caso de mi hierro d = 75'25 : 9'62 = 7'82 g./cm3.
Rápidamente me voy a consultar con la bibliografía y compruebo la densidad del hierro, que según los textos es 7'87 g./cm3. ¡Este error, no me lo puedo permitir!.
Reconozco que estuve unos días desalentado, aparentemente todo lo había hecho bien y los números no coincidían. ¿Tendría que abandonar el proyecto, con lo que a mi me gustaba?. Hasta que como iluminado por el Espíritu Santo, me di cuenta que las cosas puras no existen ni en la vida ni en la naturaleza. El hierro químicamente puro no se utiliza en cerrajería. En los altos hornos, a una temperatura de 1500 ºC. se producen las siguientes reacciones:
2 C + O2 → 2 CO
CO + 3 Fe2O3 → CO2 + 2 Fe3O4
CO2 + C → 2CO
4 CO + Fe3O4 → 4 CO2 + 3 Fe
La fundición puede contener y de hecho contiene carbono en cantidades que varían del 2 al 6 por cien, en el acero del 0'6% al 2'6% y en el hierro dulce obtenido por descarburación de la fundición menos del 0'5% de carbono.
Llegado aquí, se me ocurrió calcular la pureza del hierro que le venden al Sr. Joaquín.
Conozco el volumen de la pieza, que es de 9'62 cm3., la masa de la muestra Mm = 75'25 g. y la densidad dm = 7'82 g./cm3.
de la bibliografía obtengo: dFe = 7'87 g./cm3. y dC = 2'1 g./cm3.
Supongo que el trozo de hierro contiene solo hierro y carbón despreciando cualquier otro tipo de impureza,
luego: MFe + MC = Mm
siendo Mm la masa muestra = 75'25 g.
y a la vez: Vm = volumen muestra, VFe = volumen hierro muestra y VC = volumen carbón muestra.
y como: VFe · dFe + VC · dC = Vm · dm = Mm
VC = Vm - VFe
sustituyendo y operando:
VFe = 9'54 cm3.
VC = 0'08 cm3.
siendo la pureza del hierro del Sr. Joaquín: Pureza = 9'54·100/ 9'62 = 99'17 % del volumen.
Pero a la que vamos. Si la densidad del hierro es de 7'82 g./cm3., luego su peso aparente será Pa = 9'62 · 9'8 · ( 7'82 - d) gramos.
siendo d, la densidad del líquido en el que lo hundo.
Pa = Ma · g = V · g · (dc - d)
Ma = V · (dc - d)
Ma / V = dc - d
en donde: Ma = masa aparente, dc = densidad del cuerpo, d = densidad del medio.
sustituyendo: d = dc - (Ma / V) = 7'82 - Ma / 9'62
y como dc = Mc : Vc
también puedo escribir: d = (Mc / Vc) - (Ma / V)
y dado que Vc = V
la densidad d = (Mc - Ma) / V = (75'25 - Ma) / 9'62 g./cm3.
Ahora no tuve más que con la balanza de Salvador ir pesando, atado con un hilo de coser de masa y volumen despreciable, el hierro de Sr. Joaquín, dentro de un vaso de agua de las distintas botellas muestra y calcular la densidad, obteniendo los siguientes valores:
M - 1 : d = 1'022 g./cm3.
M - 2 : d = 1'021 g./cm3.
M - 3 : d = 1'021 g./cm3.
M - 4 : d = 1'022 g./cm3.
M - 5 : d = 1'023 g./cm3.
M - 6 : d = 1'025 g./cm3.
M - 7 : d = 1'026 g./cm3.
M - 8 : d = 1'028 g./cm3.
M - 9 : d = 1'031 g./cm3.
M - l0 : d = 1'035 g./cm3.
M - 11 : d = 1'036 g./cm3.
M - 12 : d = 1'036 g./cm3.
Así fue como supe que la densidad del agua del mar no era igual para el Mar Mediterráneo que para el Océano Atlántico, el Mediterráneo era más salado que el Atlántico y entre el norte y el sur de la Península Ibérica, cuanto más al sur el agua tenía más densidad.
Supuse que este curioso fenómeno sería debido a la evaporación, cuanto más al sur de la Península, los rayos solares cederían más cantidad de energía al agua del mar y por consiguiente, la calentarían más y evaporarían, porque el trabajo o el calor que son formas de llamar a la energía es W = f · l · cos α. La energía recibida por una molécula de agua será mayor cuanto más pequeño sea el ángulo α , siendo éste, el ángulo con el que incide el rayo de Sol en la superficie del Planeta. Desde siempre, tenía la duda del por qué en verano hace más calor que en invierno si la cantidad de energía que radia el Sol es constante y la respuesta está en el mismísimo cos α. ¡Claro!, así cualquiera comprende las cosas, la inclinación de los rayos solares varía con las estaciones.
Ya empezaba a tomarle voluntad al asunto cuando caí en la cuenta que si el agua del mar era más densa en un lugar, pero en la zona llovía mucho, de nada me serviría el invento, por consiguiente, me puse a estudiar la pluviosidad en distintas zonas de España y confeccionar un mapa de lluvias. Llegué a la conclusión que donde más llueve en la Península Ibérica es en Pontevedra, Bilbao, Guipuzcoa, Norte de Portugal y toda la cornisa cantábrica y donde menos llueve es en Zamora, Salamanca, Zaragoza, Murcia y Alicante. En el litoral mediterráneo tenemos una pluviosidad de 400 a 500 mm. de media anual en Tarragona, Castellón y Valencia; de 200 a 400 mm. de media anual en Alicante y Murcia y de 500 a 700 mm. de media anual en Almería Granada y Málaga. Era curioso, no llueve más hacia el norte, donde la densidad del agua marina es menor, sino que, en este caso llueve más en Andalucía que en el Levante. Esto demuestra que las apariencias engañan, la climatología no solo depende de la longitud y la latitud de un lugar, sino de una serie de variables difíciles de predecir sin conocimientos orográficos. Las corrientes del Gulf Stream, cuando se acercan a las costas europeas, también pueden acceder al Mar Mediterráneo por en Estrecho de Gibraltar conducidas por la Cordillera Penibética y los Montes Atlas.
Ahora ya empezaba a tenerlo un poco claro, tenía que instalar mi negocio en Alicante o en Murcia, no hay en España zona más óptima. De esta manera, me dirigí a aquellas tierras a conocer el carácter de las gentes del lugar, la orografía del terreno, los precios de las tierras, etc. Tras un largo estudio que no viene al caso y sin intención de menospreciar a nadie, elegí Alicante, concretamente al sur de Santa Pola consideré que era el lugar más idóneo.
Solo quedaba por resolver un tema: ¿cuántos kilos de sal obtendría por cada litro de agua?, pues recordemos que solo conozco la densidad del agua del mar en distintos puntos de España, pero no la concentración.
Así fue como me puse a confeccionar lo que mis Maestros llamaban una Práctica de Laboratorio.
Modus Operandi:
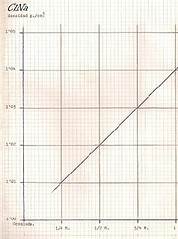
Preparé una disolución 1 molar de ClNa y calculé su densidad. Para ello disolví en 200 mI. de agua 11'69 g. de sal, obteniendo una densidad de 1'04 g./cm3.
En 200 ml. de agua disolví 8'77 g. de sal obteniendo d = 1'03 g./cm3.
En 200 ml. de agua disolví 5'85 g. de sal obteniendo d = 1'02 g./cm3.
En 200 ml. de agua disolví 2'92 g. de sal obteniendo d = 1'01 g./cm3.
Con estos valores elaboré una gráfica que relaciona la densidad de una disolución salina en función de la concentraci6n salina, de esta forma sé la cantidad de sal que contiene una muestra de agua marina sin necesidad de evaporar el agua, ni separarla de la sal, ¿no les parece curioso el método analítico?.
Una disolución 1 molar de CINa tiene una densidad 1'04 g./cm3.
Una disolución 3/4 molar de CINa tiene una densidad 1'03 g./cm3.
Una disolución 1/2 molar de CINa tiene una densidad 1'02 g./cm3.
Una disolución 1/4 molar de CINa tiene una densidad 1'01 g./cm3.
Ejemplo:
Sea una disolución salina como M - 7 con una densidad de 1'026 g/cm3, a la vista de la gráfica, le corresponderá una concentración 0'65 M. (molar). Sabiendo el peso molecular del CINa = 58'5 g. Multiplicando, la concentración será de 38 g. de ClNa por litro de disolución, en este caso de agua marina.
Como complemento a este artículo, les voy a hablar de la química del cloruro sódico.
El agua es el disolvente más importante del mundo y la de los mares, contiene disueltos todos los elementos de la naturaleza, pero el más abundante es la sal que conocemos con el nombre científico de cloruro de sodio, el protagonista de este artículo.
Las disoluciones han constituido objeto de atención desde los primeros conocimientos de la Física y de la Química, habiendo adquirido paulatinamente una importancia extraordinaria y de una manera elemental, pueden definirse las disoluciones como dispersiones de las partículas de un cuerpo (soluto) entre las de otro (disolvente). Realmente hay que considerarlas como mezclas, ya que no cumplen las leyes de la combinación, pero sus propiedades y características son tan peculiares que las diferencian de todos los demás tipos de mezclas porque de un modo aproximado, las disoluciones cumplen la condición de poder variar a discreción las cantidades relativas de sustancias mezcladas. No existe límite mínimo en cuanto a la cantidad de soluto disuelto, sin embargo, la cantidad de soluto alcanza un máximo dependiendo de las características del sistema soluto-disolvente. Esta cantidad máxima se llama solubilidad del soluto con respecto al disolvente y se acostumbra a medir la solubilidad por la máxima cantidad de soluto que se puede disolver en 100 g. de disolvente.
Cualquier disolución es siempre homogénea, existe igual cantidad de soluto y disolvente en cualquier parte de la misma y por otro lado, tanto el soluto como el disolvente conservan inalteradas sus propiedades químicas, pero no las físicas, variando ostensiblemente y en especial, los puntos de congelación y ebullición, la densidad y la presión de vapor.
Las disoluciones las podemos definir como mezclas homogéneas de dos o más cuerpos en forma molecular; la magnitud de las partículas del soluto viene a ser análoga en dimensiones a la magnitud de las moléculas o de los iones.
Según el tamaño del soluto podría clasificarlas como:
Suspensiones: Cuando las partículas dispersas son de tamaño superior a 10 -5 cm.
Suspensiones coloidales: Si las partículas del soluto están comprendidas entre 10 -5 cm. y 10 -7 cm.
Verdaderas disoluciones: Al contener partículas con un tamaño inferior a 10 -7 cm. Siendo éstas las que presentan un mayor interés para el químico.
Las disoluciones más frecuentes y a las que se presta una mayor atención por su presencia en los fenómenos químicos, son las disoluciones de só1ido en líquido, como es el caso del cloruro sódico en el agua.
Lo fundamental en una disolución, es la proporción existente entre las cantidades de soluto y de disolvente llamada concentración.
En general, cuando la proporción de soluto, respecto a la de disolvente, es pequeña, la disolución es diluida y concentrada, si la cantidad de soluto es grande. Sin embargo, estos conceptos son relativos. La cantidad de soluto que admite un disolvente es limitada, llegando un momento en que la disolución no admite más sustancia disuelta, a lo que se llama disolución saturada por contener la máxima cantidad posible de soluto; es el caso de algunos de los licores que elabora Julián Segarra en su destilería de Chert, por lo que atendiendo a este nuevo concepto, una disolución es diluida si se halla lejos de la saturación y concentrada si se encuentra próxima a ella, cual es el caso del resto de los licores que elabora Julián Segarra en su destilería del pueblo de Chert.
Pero en todos los casos hay que adoptar una manera de expresar esta concentración, por ello, es corriente emplear el sistema del tanto por ciento, pudiendo darse en gramos por cien de disolvente o gramos por cien de disolución, gramos por litro de disolvente o gramos por litro de disolución. Estas son las llamadas concentraciones en unidades físicas, pues en ellas no se ha tenido en cuenta para nada la composición o fórmula de la sustancia disuelta.
En química, son mucho más usadas las concentraciones en unidades químicas como son: molaridad, normalidad, molalidad y formalidad.
Molaridad: De una disolución, se denomina al número de moles o moléculas gramo de soluto que contiene un litro de disolución.
Así, por ejemplo, si se trata de ClNa, cuyo peso molecular es 58'5, una disolución que contenga 58'5 g. de ClNa por litro se llamará una disolución molar. (Estas disoluciones acuosas se preparan poniendo la cantidad en gramos prevista en una porción de agua suficiente para disolverla y una vez conseguido, se añade más agua hasta completar la unidad de volumen deseada).
Normalidad: Es el número de equivalentes-gramo contenidos en un litro de disolución.
El equivalente-gramo de una sustancia está relacionado con el mol por su número de valencia. Equivalente-gramo = mol : valencia, de donde se deduce que el equivalente-gramo es tantas veces inferior al mol como indique la valencia del compuesto en cuestión.
De estas consideraciones se obtiene una relación entre la normalidad y la molaridad, a saber: Normalidad = Molaridad x Valencia que en el caso del ClNa, al ser los compuestos monovalentes, la normalidad y la molaridad coinciden.
La aplicación práctica de la regla que nos dice que volúmenes iguales de disoluciones que tengan igual normalidad reaccionan por completo, se ve traducida por la siguiente fórmula tan útil en los cálculos volumétricos:
V1 · N1 = V2 · N2
Molalidad: Se denomina disolución molal la que por cada kilo de disolvente contiene un mol del cuerpo soluto, es decir, cada kilo de disolvente contiene además un mol de soluto.
Formalidad: Es llamada disolución formal la que contiene por litro de disolvente el número de gramos indicado por el peso-fórmula del cuerpo.
Es preciso tener en cuenta que, como la solubilidad varía con la temperatura, será distinta la concentración de una disolución saturada de ClNa según la temperatura a que se trabaje.
Cuando se llega a saturar una disolución por cualquier motivo, disminución de la temperatura, evaporación del disolvente, etc., resulta que la cantidad de soluto existente está por encima de la cantidad máxima admitida en aquellas condiciones, lógicamente debe depositarse el exceso de soluto en forma só1ida (precipitación) y así ocurre muchas veces, pero otras, sobretodo cuando la disolución está en reposo absoluto, parece como si el cuerpo disuelto sintiera una cierta "pereza" y no se deposita, quedando en estado de sobresaturación o disolución sobresaturada. Este es un estado inestable que se rompe fácilmente, basta agitar el líquido, o en el caso de la salina, añadir una porción só1ida de ClNa y entonces se deposita bruscamente todo el exceso en pequeñísimos cristales, siendo su observación una experiencia emotiva y gratificante.
Si existe una relación entre la variación de la solubilidad y la temperatura, también la hay entre dicha variación y el calor de disolución.
Se llama calor de disolución a la cantidad de calor desprendido o absorbido al disolver un gramo de sustancia. Apoyándose en estas relaciones, se pueden estudiar las variaciones de la velocidad de disolución. Hay que tener en cuenta que si el calor de disolución es positivo (el cuerpo al disolverse desprende calor), la solubilidad disminuirá al aumentar la temperatura, como consecuencia de la ley de Le Chatelier y aumentará, en caso contrario.
La presión y la temperatura tienen una gran influencia sobre los equilibrios químicos.
Con respecto a la temperatura, Van't Hoff dio la siguiente ley: Cuando se aumenta la temperatura de un sistema en equilibrio, la reacción se desplazará en el sentido en que absorba más calor.
Algo análogo sucede con los cambios de presión.
Al aumentar la presión, el sistema se desplazará en el sentido de producir cuerpos de menor volumen.
Así por ejemplo, en la reacción:
C12 + 2 Na → 2 ClNa
Como en esta unión un volumen de C12 reacciona con dos de Na y solo da por resultado dos volúmenes de ClNa, el aumento de presión desplazará la reacción en sentido directo. De ahí que Le Chatelier enunciase su ley diciendo:
Toda modificación introducida en las condiciones de un sistema en equilibrio, produce un desplazamiento del mismo en el sentido de restablecer las condiciones iniciales.
En general, al aumentar la concentración de un cuerpo, el equilibrio se desplaza tendiendo a eliminar ese exceso, de tal manera que la concentración del mismo vuelva a ser la primitiva. Al aumentar la temperatura, la reacción se desplaza en el sentido de producir los cuerpos que, por absorber calor de formación, consigan reducir la temperatura a la inicial. Al aumentar la presión, el desplazamiento tenderá a producir cuerpos del menor volumen para que así se restablezca la menor presión original. Por todo ello, también podemos enunciar la ley de Le Chatelier de la siguiente forma:
Toda variación en alguna de las condiciones de un sistema en equilibrio, produce un desplazamiento que se oponga a la causa que lo produce. De los postulados de la dinámica, ¿recuerdan udes. el principio de acción y reacción?.
Luego, si al disolver un cuerpo se produce un desprendimiento de calor y al mismo tiempo se aporta calor exteriormente, el equilibrio se desplazará hacia el fenómeno que absorba calor, es decir, la conversión en só1ido o la precipitación de la sustancia apenas alcance el límite de saturación. Por el contrario, si la sustancia al disolverse absorbe calor, es evidente que al calentarla se favorecerá la velocidad de disolución y la solubilidad de la misma.
Por otra parte, la naturaleza de la sustancia a disolver y la del disolvente, influyen de una manera especial, sin que pueda dar ley alguna que regule la solubilidad, de hecho, se acostumbra llamar soluble a una sustancia que lo es en más de 10 g./l., e insoluble, la que no llega al gramo por litro y poco solubles, son las comprendidas entre estos dos límites.
Experimentalmente se comprueba que, en todo disolvente que contiene algún cuerpo disuelto, la presión de vapor disminuye y como la ebullición tiene lugar cuando la presión de vapor del líquido es igual a la atmosférica, resultará que, por ejemplo, el agua, cuando tenga alguna sal disuelta, al llegar a la temperatura de 100 ºC. no tendrá una presión igual a la atmosférica como la tendría si fuera agua pura y por tanto, no hervirá, necesitando una mayor temperatura para que se produzca la ebullición.
A finales del siglo XIX, Raoult enunció su ley diciendo:
La disminución de la presión de vapor que en toda disolución se experimenta respecto a la del disolvente cuando el soluto no es volátil, es directamente proporcional al número de moléculas de soluto por unidad de volumen de disolvente.
De manera que, si llamamos Pa a la presión de vapor de la disolución, Po a la del disolvente puro y n1 y n2 al número de moléculas por unidad de volumen de soluto y de disolvente respectivamente, se verifica:
n2
Pa = Po
__________ _
n1 + n2
La ley de Raoult se explica claramente desde el punto de vista cinético. La presión de vapor depende de la velocidad con que las moléculas de un líquido escapan a la superficie. Ahora bien, si en dicha superficie existen otras moléculas extrañas de la sustancia disuelta y éstas producen atracciones e interacciones sobre las del disolvente, es evidente que la velocidad de evaporación del agua de la salina se ve retardada e interferida por las acciones de la sal disuelta, con la consiguiente disminución de la presión de vapor.
El descenso de presión, vendrá dado por la diferencia entre la presión de vapor del disolvente Po y la de la disolución Pa
P = Po - Pa
y como la relación:
Po - Pa
_________
Po
es equivalente a la fracción molar del disolvente N
n2
N =
__________
n1 + n2
queda por expresada y justificada la ley de Raoult.
Todos estos fenómenos tienen lugar con normal exactitud cuando se emplean como solutos sustancias orgánicas como por ejemplo la glucosa, pero no es así en la mayoría de las sustancias inorgánicas, en los cuales la presión de vapor es menor que la prevista por esta ley debido a la ionización de esos cuerpos.
Normalmente, por cada mol de una sal disuelta en un litro de agua se produce un aumento de 0'52 ºC. en el punto de ebullición. Ciertamente, la fracción molar del agua en una disolución molar es 55/55+1 = 55/56, ya que en 1000 g. de agua hay 1000/18 = 55 moles. Como la presión de vapor del agua a 100'52 ºC., en mmHg. es 773'7 y:
(55 / 56) x 773'7 = 760 mmHg. (1 atm.)
está claro que 0'52 ºC. es el aumento que corresponde a una disolución acuosa cuya concentración sea de un mol por litro.
Análogamente se experimenta que, en toda disolución, el punto de congelación sufre un descenso que, si bien cambia de unos líquidos a otros, es constante para cada uno, aún cuando varía en forma proporcional a la concentración. El factor de proporcionalidad llamado constante molal crioscópica, descenso que sufre una disolución que contenga un mol por kilo de disolvente, vale para el caso que nos ocupa del agua de mi salina 1'86 ºC., es decir, que una disolución en agua que contenga un mol de sal o cualquier otra sustancia, por litro, se congelará a -1'86 ºC.
En todo caso, el descenso d será:
d = Km · m
donde Km = constante molal y m = concentración molal.
Este comentario sólo es válido para disoluciones no concentradas y como el correspondiente al punto de ebullición, sufre alteraciones si el soluto es una sustancia ionizable como el ClNa.
Deseo aclarar que en una disolución acuosa, el líquido no está en equilibrio con el agua sólida, debido a que es mayor la presión de vapor del hielo que la de la disolución. En cambio, por debajo de 0 ºC. la presión de vapor del hielo disminuye mucho más aprisa que la de la disolución y es a -1'86 ºC. cuando por llegar a igualarse, viene la congelación.
Es de sobra conocido que en invierno se añade a los líquidos refrigerantes de los motores de los coches sustancias que eviten la congelación del agua del sistema de refrigeración. Serían ideales las soluciones salinas de sales muy solubles, pero por producir corrosiones en los metales no se usan, en cambio, las de alcohol, glicerina o etanodiol, son adecuadas o pueden ser excelentes.
Una mezcla frigorífica muy utilizada es la formada por hielo en mezcla con sustancias salinas muy solubles, como del ClNa. La sal se disuelve en las primeras porciones de agua que aparecen al iniciarse la fusión del hielo en forma de disolución saturada. El hielo tiene mayor presión de vapor que la disolución salina y para igualar ambas presiones, el hielo se funde, pero como en la fusión se gasta calor, la temperatura desciende. Por otra parte al aumentar la fusión se disuelve más sal, para mantener saturada la disolución y el proceso se extiende hasta alcanzar el equilibrio. Con mezclas de hielo y sal se obtiene una temperatura de equilibrio de -21 ºC.
Conviene aclarar que esta mezcla provoca un aumento de fusión del hielo, lo que explica el uso de la sal para favorecer el deshielo de la nieve especialmente en la carreteras.
Si se tiene en cuenta que en una disolución las moléculas del soluto se pueden mover en el seno del disolvente con toda libertad, puesto que las distancias intermoleculares son grandes en comparación con el tamaño de las moléculas del soluto y especialmente en las disoluciones diluidas, se comprenderá que exista una extraordinaria semejanza entre lo que ocurre en el estado gaseoso con sus moléculas en continuo movimiento y en las disoluciones.
Como consecuencia del movimiento de las moléculas, los choques de ellas con las paredes de los recipientes que contengan las disoluciones, determinan la existencia de una presión llamada presión osmótica, que, si en la práctica es inapreciable porque la presión hidrostática la enmascara, se aprecia perfectamente cuando sustituimos una pared impermeable por una semipermeable, que son aquellas que se dejan atravesar por las moléculas del disolvente, pero no por las del soluto.
El paso de disolvente a través de la pared semipermeable hace aumentar el nivel del disolvente, por el peso del incremento de altura se puede calcular el valor de la presión osmótica y así, comprobar que equivale aproximadamente a la presión que el cuerpo disuelto ejercería, supuesto gaseoso, a la temperatura en que tenga lugar la experiencia si ocupara un volumen igual al del disolvente, es decir, que siendo v este volumen, p la presión osmótica y n el número de moles disueltos:
p · v = n · R · T
luego p = (n/v) R T, siendo n/v la concentración molar.
La experiencia ha demostrado la veracidad de esta fórmula y por ello se sabe que un mol de cuerpo disuelto en 22'4 litros presenta la presión de una atmósfera a 0 ºC. Si un mol de un gas ocupa 22'4 l. a 0 ºC., al reducir su volumen 22'4 veces, a temperatura constante, por la ley de Boyle (p · v = k si la temperatura es constante) su presión se hará 22'4 veces mayor y análogamente, la presión osmótica de una disoluci6n que contenga un mol de soluto por litro será 22'4 atmósferas.
Esto da lugar a un método para calcular pesos moleculares ya que si se sabe que la presión de 22'4 atm. corresponde a un mol por litro, midiendo la presión osmótica de una disolución, se puede, por un sencillo cálculo de proporcionalidad, hallar el peso molecular.
Pero para comprender las cosas no hay nada como un ejemplo:
Así, si se toma una disolución y se halla su presión osmótica, siendo ésta de 5'6 atmósferas, se deduce que esta disolución tiene 1/4 de mol por litro, sabiendo que su concentración en gramos litro es de 14'6, resulta que al ser su presi6n 1/4 de lo normal, 14'6 g. es 1/4 de su peso molecular, luego su peso molecular es 14'6 x 4 = 58'4, peso molecular del ClNa, por consiguiente, conociendo el peso molecular del ClNa y la presión osmótica de una muestra de concentración desconocida, puedo averiguar rápidamente su valor en gramos litro sin necesidad de calcular su densidad. Pero para que vean udes. que todos los caminos conducen al mismo sitio, otro tanto se puede hacer con la disminución del punto de ebullición y del punto de congelación.
Si una disolución se congela a -0'62 (1'83/3 = 0'62), es señal de que tiene como concentración 1/3 de mol... ¿es necesario continuar con el ejemplo?.
Hasta finales del siglo XIX, el átomo seguía siendo considerado corno una minúscula esfera indivisible, distinta de unos átomos a otros y de cuya unión resultaban las moléculas. La Química actual dispone de gran número de partículas que intervienen en la formación del átomo, tres de ellas son estables y pese al gran avance realizado por la Ciencia desde mediados del siglo XX, la estructura y constitución del átomo puede explicarse mediante las tres partículas fundamentales, el neutrón, el protón y el electrón.
Por el momento, lo que nos interesará a nosotros para estudiar su comportamiento es la estructura electrónica, distinta para cada uno y su conocimiento es fundamental para determinar las propiedades físicas y químicas de los elementos, así como las fuerzas de enlace con que se unen los átomos de los diferentes elementos al formar las moléculas.
Está probado de forma indiscutible, luego no les dejo a udes. opción a pensar en lo contrario, ni tampoco les acepto que me exijan demostración, que la causa de la inmensa mayoría de las propiedades de un elemento estriba en la configuración electrónica de la capa externa de sus átomos, en ella, el máximo número de electrones que se encuentran es de ocho para los gases nobles. También se aprecia que todos los elementos de un mismo grupo o familia poseen idéntica configuración electrónica externa.
Todos los sistemas materiales tienden a adoptar el estado de mínima energía potencial y los átomos, tenderán a adoptar la configuración electrónica que les confiera la menor energía, es decir, la configuración de gas noble. Si un elemento posee menos de cuatro electrones en su capa externa "procura" perderlos, con lo cual la capa externa será la anterior que está completa. Si tiene más de cuatro, tiende a ganar los que le faltan para llegar a ocho, completando así la capa externa. Cuando un elemento tiene cuatro electrones en su capa externa, le será lo mismo ganar cuatro que cederlos.
Con estas consideraciones, se modifica el concepto clásico de valencia, poniéndolo ahora en función de estos intercambios de electrones externos. La valencia electroquímica la definiré corno la tendencia o capacidad de un átomo para ceder o captar electrones. Si la tendencia es a perder electrones, el elemento es un metal, en caso contrario es un no metal. Cuando la ganancia o la cesión tienen las mismas posibilidades y el elemento puede actuar de ambas formas, recibe el nombre de anfótero.
Así de sencilla es la formación de los iones. Un ión es un átomo que ha tomado carga positiva o negativa por perdida o ganancia de electrones y como se toma un electrón por unidad de carga, el número de cargas de un ión es siempre entero.
La formación de los iones se reduce a dos casos:
X + n e - → X -n
X - n e - → X +n
Ejemplo:
Cl + 1 e - → Cl -
Na - 1 e - → Na+
Interesa conocer la tendencia relativa que tienen los átomos para convertirse en iones, lo cual puede saberse por la energía liberada o absorbida en el proceso de formación.
Para convertir un átomo en ión monopositivo hay que dar energía suficiente para compensar la fuerza con que el electrón está unido al átomo. El proceso es endotérmico. La energía necesaria para quitarle el electrón al átomo se llama Potencial de Ionización, I.
El potencial de ionización será primero, segundo, tercero, etc., si se trata de quitar el primero, segundo, tercero, etc., electrón del átomo.
En el caso del Na: I = 5'12 eV. (electrón-volts).
Dentro de un grupo del sistema periódico, el valor del potencial de ionización disminuye a medida que se avanza en el grupo. La estructura electrónica externa es la misma en todos ellos, pero cada elemento del grupo se diferencia del anterior en tener una capa más, con lo que el electrón más externo está más lejos del núcleo y por tanto, menos atraído electrostáticamente por éste, a causa de la cual, hace falta menos energía para desplazarlo.
En el caso del Cl: I = 12'95 eV.
Pero el valor de la energía es mucho mayor, pues en la capa externa, como todos los halógenos, tiene siete electrones y tiende a ganar el octavo, por ello, la pérdida de un electrón lo aleja de la estabilidad y hay que emplear más energía para quitárselo.
En el proceso de formación de un ión negativo se libera energía, pues el electrón se une al átomo por fuerzas atractivas. Esta energía recibe el nombre de Afinidad Electrónica, E.
La ganancia de un electrón supone alcanzar la estructura electrónica de gas noble y la estabilidad ganada se manifiesta en un desprendimiento de energía que en el caso del Cl que me ocupa es de: E = 3'75 eV.
Dentro del grupo de los ha1ógenos la afinidad electrónica disminuirá de arriba abajo y en el caso de los alcalinos y semejantes, será cero, pues la tendencia a ganar electrones es nula.
La suma de ambos factores, potencial de ionización y afinidad electrónica, según Mullikan, nos dice de la electronegatividad de un ión. Efectivamente, un alto valor, tanto del potencial como de la afinidad, indica que el elemento es muy electronegativo, o tiende a pasar a ión negativo, mientras que los valores bajos indican poca electronegatividad.
Al mismo tiempo que su sistema periódico, Meyer publicó la primera curva representando la variación de los volúmenes atómicos. Con las debidas correcciones impuestas por la mayor exactitud de los pesos atómicos, esta curva de mantiene hoy en uso.
El volumen atómico se halla por la relación entre el peso atómico y la densidad y se expresa el volumen ocupado en cm3., por 6 x 1023 átomos.
Para el Na: V. a. = 22'8 cm3.
Para el Cl: V. a. = 16'3 cm3.
En un grupo o familia, el volumen atómico crece de arriba abajo, puesto que un elemento se diferencia del anterior en que tiene una capa más, aumentando la distancia del núcleo a la superficie exterior. Si se trata de un periodo, en principio el volumen atómico disminuye, el número de capas es el mismo, en cambio, va aumentando el número de protones y electrones y con ellos aumentan las fuerzas atractivas de Coulomb, haciendo que el volumen ocupado sea menor. Hacia la mitad del periodo, el volumen vuelve a aumentar. Al principio, los electrones de la capa externa son pocos, se encuentran alejados y no se interaccionan excesivamente, pero conforme su número va aumentando, la densidad electrónica es mayor y aparecen entre ellos fuerzas repulsivas cada vez mayores que compensan la atracción del núcleo y provocan el aumento de volumen.
Ahora que ya conozco los iones y su formación, me interesará saber como se unen para formar las moléculas o cristales. Este tipo de enlace, llamado enlace químico, se verifica tanto en las moléculas de compuestos como en la de los elementos y el conocimiento de su naturaleza es fundamental, porque una reacción no es más que la desaparición de unos enlaces y la formación de otros que, regido por la energía que se intercambia en el proceso, originarán nuevos productos.
De todas las formas conocidas en que los átomos pueden unirse, selecciono estas tres consideradas como enlaces químicos puros:
Enlace iónico es llamado a la unión que aparece en la formación de compuestos obtenidos por la asociación de elementos muy electro negativos (por ej., halógenos) con elementos muy poco electronegativos (por ej., alcalinos). Se denomina también enlace polar o heteropolar. Es el caso del ClNa.
Enlace covalente, apolar u homopolar que es el que aparece en las moléculas formadas por átomos del mismo o de distintos elementos, siempre muy electronegativos, o de electronegatividad similar. Es el caso del C12.
Enlace metálico se denomina cuando causa la unión de los átomos de uno o varios elementos poco electronegativos o metálicos. Es el caso del Na.
Aunque no entra dentro del campo estrictamente químico, cabe mencionar otro importante tipo de unión, es el responsable de la unión entre moléculas que ya están saturadas, se trata de unas fuerza intermoleculares conocidas como de Van der Waals.
Deseo aclarar que los enlaces absolutamente puros se dan muy raras veces en las moléculas o cristales de las sustancias químicas. Mucho más frecuentes son las situaciones intermedias, en las que hay participación de varios tipos de enlace a la vez.
En este artículo sobre la sal de mi salina, el ClNa, me interesa estudiar el enlace iónico y puedo definirlo como la unión por fuerzas electrostáticas de Coulomb que se producen entre iones positivos e iones negativos, aunque el enlace iónico, exige como proceso previo la ionización de los átomos.
Un elemento muy electronegativo, por ejemplo, el cloro, gana con facilidad un electrón, mientras que otro poco electronegativo, por ejemplo el sodio, lo pierde también fácilmente. De esta forma los átomos de cloro y sodio se transforman en aniones y cationes, respectivamente. Los iones de signo contrario formados se atraen, quedando constituido el enlace iónico.
Todo proceso que se realice espontáneamente en la Naturaleza, ha de ir acompañado de una disminución de la energía potencial del sistema, pues, en caso contrario, dicho proceso conduciría a una situación inestable. Por ello, la unión entre el cloro y el sodio tendrá lugar solamente si el cloruro de sodio obtenido tiene menor energía potencial que la que poseían en total los elementos por separado antes de producirse la unión.
En la ionización del sodio, proceso endotérmico que requiere la energía llamada potencial de ionización, se gastan 5'12 eV. cantidad elevada debido al pequeño volumen del sodio. El cloro, que tiene en su capa externa siete electrones, cuando se apodera de uno, desprende 3'75 eV. Como puede comprenderse, el sistema formado por un átomo de cloro y un átomo de sodio, puede estar indefinidamente sin que ocurra nada, los átomos no se atraen, pero a temperatura elevada, en estado de vapor, cuando aportamos la diferencia entre la energía potencial y la afinidad, el sodio desprende un electrón que lo recoge el cloro, constituyéndose en iones que se ven atraídos enérgicamente por las fuerzas de Coulomb. Por otro lado, es imposible la ionización de un solo átomo de cada elemento y se produce simultáneamente la de grandes cantidades de ellos. Cada ión se constituye en centro creador de un campo eléctrico, positivo o negativo, que se rodea de los campos de signo contrario, orientándose respecto a ellos.
En la unión iónica, un ión tiende a rodearse del mayor número posible de iones de signo contrario, formando una red cristalina, pero no moléculas individuales.
Llegados aquí, conviene que les aclare la diferencia que hay entre una red cristalina y una molécula. Una molécula está formada por un número limitado de átomos, mientras que en la red iónica, el número de iones es indefinido.
En un compuesto constituido por moléculas, la fórmula indica el número y clase de átomos que forman cada una de estas. La fórmula de un compuesto iónico indica solo la cantidad relativa de iones de cada clase y en el caso del ClNa, esta fórmula indica el número de iones Cl - que existen por iones Na+ y tantos como haya de uno ha de haber del otro, para que se mantenga la neutralidad eléctrica.
En los cristales o complejos cristalinos, se llama número de coordinación al número de iones de un signo que rodean a un ión de signo contrario. Este número de coordinación depende del tamaño relativo de los iones, una vez salvada la premisa fundamental de la neutralidad eléctrica del conjunto.
Cuando se forma una red cristalina, los iones se orientan, atrayéndose los de signo contrario hasta que sus envolventes electrónicas entran en contacto, quedando los núcleos a una distancia que es la suma de los radios iónicos.
Hay que tener en cuenta que el radio de un ión no es igual al del átomo del que procede. Si el ión formado es positivo, se produce una reducción de volumen. Al perder electrones un átomo, la carga nuclear sigue siendo la misma y al repartirse entre menos electrones, la fuerza atractiva es mayor y el volumen disminuye. Por el contrario, cuando se forma un ión negativo, la llegada de nuevos electrones a la envolvente externa aumenta la repulsión entre ellos, provocando un incremento de volumen.
Como comprenderán udes., el factor radio iónico es tan importante que si me enrollara como una persiana con sus explicaciones, este tema parecería una ventana y a buen seguro se dormirían, pero no crean que es el único factor determinante de las estructuras cristalinas de los compuestos iónicos, tan importante como él y a la vez decisivo, es el de la neutralidad eléctrica.
En el caso por ejemplo del ClNa de mi salina, debido al tamaño del Cl - con relación al Na+ se puede comprobar que alrededor del Cl - caben 12 Na+, mientras que alrededor de cada Na+ solo pueden situarse 6 Cl -. Por razón de radio iónico habría doble cantidad de sodio que de cloro, pero la neutralidad eléctrica impone que haya la misma cantidad de uno que de otro. Esta cantidad ha de ser 1ógicamente la menor, por lo que el número de coordinación del ClNa es 6:6.
No obstante, los rayos X fueron una gran ayuda en la determinación de las estructuras de los compuestos iónicos. Estudiando e interpretando las figuras de difracción producidas por ellos al atravesar los cristales iónicos, se pudo conocer la disposición de los iones en éstos.
Deseo aclarar que en el estudio de las estructuras, se supone que los iones se comportan como esferas rígidas. Realmente estas esferas se encuentran haciendo contacto entre ellas, pero, para facilitar su comprensión, en la bibliografía las verán dibujadas o representadas separadas en el espacio.
A pesar del gran número de compuestos iónicos existentes, las estructuras cristalinas que se presentan en la Naturaleza se reducen a seis tipos diferentes.
En el caso del cloruro de sodio, los iones de un signo ocupan los vértices y los centros de las caras de un cubo. El otro ión se coloca en los centros de las aristas y en el centro geométrico del cubo. En esta disposición cada ión de un signo se rodea de seis del signo contrario. D. Pedro Monzó Fuster les mostrará unos cristales de sal (ClNa) que le envío para facilitarles la comprensión de este tipo de estructura cristalina.
Lo explicado hasta ahora no es más de lo que la experiencia nos dice de los compuestos iónicos, pienso que sería interesante conocer por qué suceden así las cosas.
Considerando los iones como esferas cargadas, las uniones entre átomos son de tipo electrostático, por fuerzas de Coulomb, de forma que el campo eléctrico creado por ellas es uniforme en todas las direcciones.
Sean dos iones como el Cl - y el Na+ de signo contrario, cuando se encuentran a una distancia lo suficientemente grande, no se atraen, pero a medida que se van acercando, aparecen y se van incrementando las fuerzas de Coulomb. En un principio se suponía que los iones eran esferas indeformables e incompresibles, con lo que la distancia mínima a que podían situarse era la suma de sus radios. Sin embargo, existe el fenómeno de la compresibilidad, la distancia entre ellos puede hacerse tan pequeña como se quiera. Ahora bien, cuando la compresión es grande y los núcleos llegan a estar demasiado cerca, aparecen fuerzas repulsivas que se hacen muy grandes para distancias muy pequeñas. Estas fuerzas también son del tipo coulombiano. La resultante entre las fuerzas atractivas y repulsivas es otra fuerza en la que lo más destacable es la distancia de equilibrio, donde ambas fuerzas se anulan y a la que se sitúan ambos iones.
La energía de la unión entre dos iones se puede calcular matemáticamente a partir de los datos que proporcionan las fuerzas atractivas y repulsivas para el punto de equilibrio. Esta energía se conoce con el nombre de Energía Reticular y se representa en los textos por Uo y su fórmula es:
z1 · z2 · e2 1
Uo = ( 1 )
___________ _ ___
do n
siendo la energía con que se unen dos iones, de cargas z1 y z2, en dónde e es la carga unidad y encontrándose en equilibrio a una distancia do. Al valor n se denomina factor de compresibilidad y se conoce a partir de medidas experimentales. Pero como los dos iones no se encuentran aislados como se da a entender, sino que se hallan dentro de una red de cloruro de sodio y cada ión se encuentra dentro del campo electrostático general, estando influenciado por los que le rodean tanto más cuanto más cerca se encuentren, se impone un factor de corrección en la fórmula anterior de la energía reticular,
z1 · z2 · e2 · A 1
Uo = ( 1 )
______________ _ ___
do n
en donde A, es la llamada constante de Madelung, cuyo valor depende de la estructura cristalina del compuesto que mi caso para el cloruro sódico vale 1'747558. Por último y con objeto de referir Uo a conceptos de fácil manejo, les diré que, se la suele expresar en valores por mol, por lo cual hay que multiplicar la expresión por N, el número de Avogadro, quedando definitivamente como:
z1 · z2 · e2 · A · N 1
Uo = ( 1 )
_________________ _ ___
do n
Hay que aclarar que los valores obtenidos para la energía reticular no son rigurosamente exactos, pero sí lo suficientemente aproximados como para poder enjuiciar el comportamiento de los compuestos iónicos.
Un compuesto iónico será tanto más estable cuanto mayor sea el valor de su energía reticular, que depende principalmente de la carga, radio y configuración electrónica de los iones. Para el cálculo de la energía reticular es muy importante el conocimiento de los radios iónicos, dado que su valor depende directamente de do, donde do = r - + r +, siendo éstos los radios de los iones negativo y positivo respectivamente, problema resuelto por Bragg utilizando los datos obtenidos en la difracción de rayos X.
La energía reticular guarda relación íntima con los puntos de fusión y de ebullición. Un cristal pasa de estado sólido a líquido cuando la energía térmica compensa a la del retículo. En el caso del ClNa, do vale 2'81 Å y su punto de fusión es de 801 ºC.
La dificultad que ofrecen los só1idos a ser rayados se llama dureza y esta propiedad, también de los compuestos iónicos, se puede medir, para ello se usan valores relativos de 1 a 10 siguiendo la escala de Möhs, que no es única.
Rayar un sólido significa romper un cierto número de enlaces, por ello la dureza es proporcional a la energía reticular. Al ser la carga y el radio los factores más importantes de los que depende la energía reticular, un aumento de la primera o una disminución del segundo se traducen en un incremento de la misma, siendo elevada en los compuestos iónicos.
Los puntos de fusión y ebullición no son las únicas propiedades de la energía reticular, relacionada con ella también se encuentra el coeficiente de dilatación.
La dilatación es un aumento de volumen, lo que supone aumento de las distancias interiónicas forzando la energía del enlace, por tanto, cuanto mayor sea la energía del retículo, mayor será la energía térmica necesaria para provocar la dilatación. Para el ClNa, el coeficiente de dilatación vale 4 · 10 -5.
En toda reacción química, como quiera que a cada miembro de ella le corresponde un contenido propio de energía antes y después de la reacción, hay una variación de energía, de tal manera que la reacción no es solo una transformación que afecte a la materia, sino al propio tiempo a la energía. Recuerdo que al finalizar los estudios, un buen día me pregunté: ¿tantos años estudiando la Química y es posible que no sepa lo qué es?, por eso, para que no se olviden udes. nunca, es por lo que les he dicho y repito que, es la transformación conjunta de la materia y de la energía. Al disolver ClNa en agua, o al evaporar el agua en la salina no hacemos Química, porque no transformamos nada.
La transformación de energía que se produce en la reacción química puede hacerse en las diversas formas de ella, a saber, luz, calor, electricidad, etc., aunque la más corriente es la de tipo calorífico.
Con referencia a las variaciones de energía térmica, las reacciones pueden ser exotérmicas o endotérmicas. Las primeras son aquellas en cuyo transcurso se origina un desprendimiento de calor, en las segundas, hay absorci6n de calor.
Sea el caso del ClNa de mi salina. Un átomo de cloro y otro de sodio se unen, siendo la reacción exotérmica y desprendiendose en ella un calor Q:
1/2 C12 + Na → CINa + Q
Esta reacción puede realizarse en varios pasos:
a) El átomo de sodio debe convertirse en estado gaseoso y para llevarlo a él desde la masa metálica en que se encuentra, hay que suministrarle una energía, S y así poderlo sublimar:
Na (metálico) + S → Na (gas)
b) Para que se produzca la unión, ambos átomos han de pasar a estado de iones.
El átomo de Na hay que privarle de su electrón externo, proceso en el que se gasta una pequeña cantidad de energía, que es el potencial de ionización, I, ¿lo recuerdan udes.?:
Na + I → Na+ + le -
c) El cloro gaseoso se encuentra en forma de moléculas y para obtener un átomo hay que proceder a la disociación de una de aquellas, gastándose una energía de disociación, D :
1/2 C12 + 1/2 D → Cl
El electrón desprendido por el Na es captado por el átomo de cloro que, con él, adquiere configuración electrónica de gas noble y con ello, una mayor estabilidad, desprendiéndose la energía llamada afinidad electrónica, E:
C1 + le - → Cl - + E
e) Los dos iones formados se unen y de esta unión surge precisamente la energía reticular, Uo:
Cl - + Na+ → C1Na + Uo
Legados aquí, es de reconocer la especial importancia de la ley de Hess, cuyo enunciado dice:
Cuando se parte de un estado inicial y se llega a un estado final, el balance de energía es siempre el mismo, independientemente de los estados intermedios por los que el proceso transcurriese.
Aplicando esta ley de Hess, el calor Q desprendido en el primer proceso, ha de ser igual a la suma de los calores parciales consumidos y desprendidos en el segundo procedimiento:
Q = Uo + E - 1/2 D - I - S
expresión de la que despejando la energía reticular:
Uo = Q - E + 1/2 D + I + S
obteniéndose valores experimentales para esta importante magnitud, que concuerdan con bastante aproximación con los calculados teóricamente.
De esta forma, podemos saber un poco más del ClNa, del por qué de su existencia en la Naturaleza y de los iones que lo forman, pero todo esto no serviría para nada si no supiésemos de su utilidad para las personas.
Todos sabemos que la sal se usa en la cocina, ¿adivinan udes. por qué cuando hablamos de las mujeres, decimos que tienen mucho salero. "Ji", "ji", "ji", ... pero si toda la sal que se obtiene en la Tierra, solo tuviese el mercado gastronómico como fin, de cada diez salinas, sobrarían nueve. La gran mayoría de la producción salina se utiliza en la industria.
Los cuerpos que conducen la electricidad se llaman conductores y los que impiden su paso son aisladores. Los metales, merced al gas electrónico, permiten el paso de la corriente al establecer un tránsito de electrones. En la conducción de la corriente a través de los metales no se produce reacción química de ninguna clase. Al cesar el paso de la electricidad, el conductor aparece exactamente igual que antes, sin haber sufrido ningún cambio de materia. Este tipo de conductores son los llamados de la primera especie.
Al fundir un compuesto iónico, los iones salen de la red cristalina y adquieren una libertad que les permite moverse y orientarse. Lo mismo ocurre al disolverlo. Los iones pierden su primera ordenación y pasan al seno del disolvente, donde están dotados de movimiento.
Hay que advertirles a udes. que los iones de una disolución no se encuentran de la misma forma que los iones aislados. El hecho de que un compuesto iónico se disuelva, indica que el disolvente es polar, poseyendo sus moléculas momento dipolar. Cada ión de la sustancia disuelta, soluto, se rodea de un cierto número de moléculas de disolvente, fenómeno que se llama solvatación y en el caso particular del disolvente agua, llamaremos hidratación.
Los compuestos iónicos, tanto fundidos como en disolución, conducen la electricidad, pero el paso de ésta va acompañado de una serie de procesos y reacciones químicas que, causando su descomposición se les llama conductores de segunda especie o electrolitos.
El fenómeno de la conducción de la electricidad a través de los electrolitos recibe el nombre de electrólisis. Fue en principio estudiada por Davy y Berzelius, pero quien la abordó y resolvió por completo fue Faraday, en el primer cuarto del siglo XIX.
En un recipiente llamado cuba electrolítica o voltámetro, en el que se deposita el electrolito fundido o disuelto, se introducen dos electrodos, entre los cuales se establece un potencial eléctrico. Por efecto del campo eléctrico, los iones se orientan. Los negativos se llaman aniones porque se dirigen al polo positivo, llamado ánodo y los iones positivos, cationes, van al cátodo.
Al fundir el ClNa, sus iones adquieren movilidad. Si se encuentran sometidos a un campo eléctrico, dentro de una cuba electrolítica, los iones Cl - se encaminan hacia el ánodo y los Na+ al cátodo, en cuyos electrodos se desarrollan los siguientes procesos:
En el cátodo, los electrones de que está formada la corriente eléctrica se depositan sobre los iones Na+. Cada ión capta un electrón y se transforma en átomo neutro, depositándose sobre el cátodo
Na+ + le - → Na
En el ánodo los iones Cl - ceden su exceso de carga y cada uno pierde un electrón convirtiéndose en átomo. Estos átomos se unen por parejas, formando moléculas de cloro que, por ser gaseoso, se desprenden:
Cl - → Cl + le -
Cl + Cl → C12 ↑
En la industria como ánodo se utiliza el carbono y como cátodo el hierro, aunque en ocasiones también se emplea el mercurio. Si se utiliza el cátodo de hierro es porque las reacciones químicas conducen a la formación de cloro, que se desprende, e hidróxido sódico, que se queda disuelto y desprendiéndose hidrógeno en el cátodo. Se suponen las reacciones siguientes:
2H2O + 2e - → H2 + 2OH - en el cátodo.
2Cl - → Cl2 + 2e - en el ánodo.
Sin embargo, la cosa no transcurre de un modo tan sencillo pues pueden presentarse reacciones secundarias que es preciso evitar.
El cloro formado puede reaccionar con el agua:
Cl2 + H2O → Cl - + H+ + ClOH
A la vista de los hechos, hay que evitar la disolución del cloro a toda costa, ¿que cómo conseguirlo?, muy sencillo, recordando las explicaciones que les hice a udes. anteriormente. Efectivamente, aumentando la concentración de cloruro sódico y la temperatura, el problema deja de serlo.
Si la concentración de lejía alcalina (disolución de NaOH), llega a hacerse muy elevada, el ión OH - se descarga en el ánodo al igual que el Cl -, formándose O2 que impurifica al C12.
2OH - → H2O + 1/2 O2 + 2e -
por los que se consume corriente y no solo inútilmente, sino en perjuicio de la calidad del producto obtenido.
Este inconveniente se evitará impidiendo que la sosa cáustica alcance concentraciones elevadas, para lo cual se mantiene un flujo constante de salida de lejía alcalina.
El cloruro sódico como el de mi salina, no es puro, siempre lleva alguna impureza como los sulfatos. El ión sulfato reacciona con los hidroxilos:
SO4= + 2OH - → SO4H2 + O2 + 2e -
produciéndose el mismo inconveniente que en el caso anterior.
Como verán udes., de sustos no salimos, pero la gracia y pericia del Químico, hace que para grandes males, tenga grandísimos remedios, por tanto, no se preocupen porque, la solución nos viene de la mano del cloruro de bario. ¡Aquí, el que se asusta es porque quiere!
SO4= + Cl2Ba → S04Ba↓ + 2Cl -
el sulfato de bario, sustancia muy insoluble, precipita.
Los aparatos más utilizados en la electrolisis del cloruro sódico disuelto, son las células Hooker's, pues dan un rendimiento superior a las demás. Consisten en una caja de cemento, ¡a ver ese de ahí atrás, que no se ria!, ¡no va a ser de cartón!, aunque alguien crea que pueda ser de hierro, le diré que no es posible, el hierro con la sal se transforma (reacciona) en cloruro de hierro y a los quince días te quedas sin depósito. ¡Vale!. En el depósito de cemento, como les decía, los ánodos de grafito están insertados en plomo en el fondo, la corriente llega hasta el plomo a través de un hilo de cobre. Los cátodos de hierro están entre los ánodos, tienen forma de rejillas, recubiertas con amianto que hace de diafragma por donde pasan los protones que, una vez descargados van al colector general de hidrógeno que rodea la célula.
No les voy a hablar de la importancia del cloro, pero si alguien tiene alguna duda sobre su aplicación, le remito al grifo de agua de suministro municipal.
Entre las técnicas más modernamente incorporadas a la investigación y a la industria, es la del cambio iónico, para la que, de día en día, se descubren nuevas e importantes aplicaciones. No obstante, pese a lo moderno de su descubrimiento y utilización, el cambio iónico viene realizándose en la Naturaleza desde el principio de la Creación.
Las primeras observaciones a cerca de este fenómeno fueron realizadas por Thomson y Spence hacia 1845. Observaron el comportamiento del suelo al adicionarle sulfato amónico. Esta sal es descompuesta por la tierra, que absorbe el amonio y deja como residuo el sulfato cálcico.
Way, como consecuencia de sus investigaciones, encontró que este fenómeno no era propiedad única y exclusiva del sulfato amónico, sino que otras muchas sales de sodio, potasio, magnesio, etc., son también transformadas en sales cálcicas por la acción del suelo. El proceso es de naturaleza química y los responsables son unos silicatos de aluminio, productos naturales del suelo, que reciben el nombre de zeolitas, aunque también realizan el cambio iónico otros silicatos fabricados artificialmente, como las permutitas, cuya fórmula es Si04AlNa.
La primera aplicación práctica del cambio iónico fue encontrada por Gans en 1905, en la descalcificación de las aguas duras. El procedimiento consiste en filtrar el agua dura a través de capas de zeolitas o permutitas. Los iones cálcicos del agua son cambiados por iones sódicos del filtro y el agua queda reblandecida. Con el tiempo, el cambiador de iones se satura de calcio, pero al lavarlo con solución de sal sódica se efectúa el cambio contrario y queda de nuevo en condiciones de utilización.

En 1935, Adams y Holmes fabricaron una resina sintética dotada de fuertes propiedades cambiadoras. Se ha investigado mucho desde entonces y actualmente se fabrican resinas tanto catiónicas como aniónicas, aunque las más conocidas por ustedes, posiblemente son las utilizadas en el reblandecimiento del agua, cuya regeneración se realiza gracias al cloruro sódico.
Observarán siempre de la existencia de un tema útil, el problema reside en saber cuál es el mejor, para después poder elegirlo, por ello conviene estudiarlos todos, así con conocimiento total, podremos decidir. En esta vida todo guarda relación y lo que no sirve para una cosa, sirve para otra, aunque lo mejor está en la grandísima diversidad de aplicación de temas o ideas muy concretas. Gracias a las enseñanzas recibidas de mis Maestros, monté mi negocio que está creciendo día a día adquiriendo tierras lindantes de las que acompaño una fotografía para que puedan valorar el alcance del mismo.
Si en su largo caminar por la vida, recuerdan ustedes una sola línea de las contenidas en este tema, tengan por seguro que me sentiré dichoso. ¡Suerte y acierto!.
"Lo Lleó del Maestrat"
Noviembre de 1.988.
© Copyright Julián Segarra Esbrí - 2.013